Process Pembuatan Gas Sintesis Amonia 1 (Menggunakan Reaksi Kimia)
Amonia (gas) tu terdiri dr hidrogen & nitrogen-yg biasanya perbandingan molarnya 3:1-, trus ada metan, argon, & lil’ CO2. Amonia disintesis pake reaksi reversibel antara hidrogen dengan nitrogen. Reaksinya persis kayak yg dibawah:

Seperti halnya reaksi revesibel lain, reaksi pembentukan ammonia juga menghabiskan tenaga dan pikiran untuk mengeset reaksi supaya bisa ngeset jumlah amonia pada kestmbngn pada macam-macam temperatur & tekanan. Yang pasti berhubungan dengan konstanta kesetimbangan reaksinya.
Kp (konstanta kesetimbangan) tersebut tidak hanya tergantung ke temperatur & tekanannya, tapi juga ke perbandingan komposisi nitrogen & hidrogen.
Sumber nitrogen tu biasanya udara. Dan sumber hidrogen biasanya di dapat dari berbagai jenis bahan mentah seperti air, hidrokarbon ringan/berat hasil dari pemurnian minyak mentah, gas alam, maupun kombinasi dari bahan2 itu yang memiliki kandungan hydrogennya.
Tabel berikut dibawah nunjukin macam-macam reaksi untuk macam-macam bahan mentah yg dipakai untuk produksi hidrogen.
Reaksi2 tersebut, kecuali elektrolisis air, diikuti dengan reaksi pergeseran CO (water-gas shift reaction=WGSR).
Tabel reaksi pembuatan hidrogen
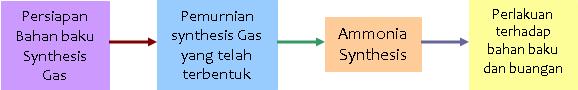
Berikut akan dijelaskan salah satu tahapan-tahapan proses pembuatan ammonia yang kami tahu (secara garis besarnya tentu). nitrogennya berasal dari udara dan hidrogennya berasal dari Natural Gas. Tahap-tahapan pembuatan ammonia:
Tahap Pembuatan Ammonia
Tahap 1:Persiapan bahan baku gas sintesis
Terdiri dari 4 tahap yang besar:
Flowchart persiapan bahan baku syn Gas
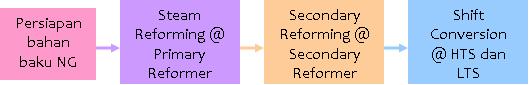
Tahap 1.1: Persiapan bahan baku NG:
Flowchart persiapan bahan baku NG
bahan baku NG bisa saja mengandung partikel(solid)/liquid yang mengganggu proses compressionnya, sehingga seluruh partikel yang mengganggu tadi harus di remove di KO Drum terlebih dulu. Kemudian di coalescer terlebih dahulu untuk make sure tidak ada liquid yang terikut. Dari situ baru di kompresi untuk menaikkan tekanan. Inti dari reaksi steam reforming adalah tekanan dan suhu operasi yang optimum sehingga dapat mengoptimalkan produk yang diinginkan. Setelah di kompresi, Feed gas kemudian di preheating. Panas yang digunakan bisa diambil dari panas primary reformer untuk menghemat biaya utilitas. FG kemudian dimasukkan hydrotreater yang mengandung katalis (e.g. CoMo, katalis ini bisa berumur 3-5 tahun untuk kemudian harus diregenerasi.), untuk mengubah merkaptan (disulfide) yang terkandung dalam HC, menjadi H2S yang terpisah dari HC dan bisa diserap pada tahap selanjutnya yaitu tahap desulfurisasi. Pada tahap desulfurisasi ini menggunakan katalis ZnO.
Tahapan reaksinya:
Reaksi hydrotreating dan desulfurisasi
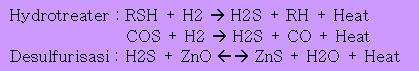
Tujuan menghilangkan Sulfur ini adalah sematamata karena sulfur mengganggu reaksi sintesis ammonia. Dan dari reaksi kedua yang ada di hydrotreater terlihat ada CO yang terbentuk. Hal ini bisa jadi bertambahnya beban pada methanator nantinya (lihat penjelasan berikutnya). Tapi tidak ada cara lain. Selain itu juga bila kandungan CO2 atau ammonia di FG besar, akan menghambat penyerapan H2S oleh ZnO karena ZnO akan terlebih dulu bereaksi dengan CO2 menghasilkan hidratnya, dan ammonia akan menghambat kerja
Tahap 1.2:Steam Reforming
NG bebas sulfur dari tahap 1.1 dicampur dengan steam medium pressure dengan ratio Steam/Carbon atau S/C tertentu, untuk kemudian disteam reforming, hingga intermediate levelnya terbentuk. Karena membutuhkan steam, makanya disebut Steam Reforming. Steam reforming ini dilakukan dalam primary reformer catalyst tubes yang ada didalam furnace. Panas yang diperoleh dari membakar fuel gas.
Reaksi yang terjadi dalam primary reformer:
[GAMBAR6: reaksi dalam primary reformer]
Overall reaksi diatas adalah endoterm. Sebenarnya karena heat yang dibutuhkan oleh reaksi endoterm jauh lebih besar daripada heat yang dihasilkan oleh reaksi eksoterm yang lainnya, sehingga tetap dibutuhkan panas dari hasil pembakar fuel gas. Katalis yang digunakan adalah Nikel.
Tahap 1.3:Secondary Reforming
Secondary reforming dilakukan dalam secondary reformer. Diproses ini metana yang masih bersisa di kurangi dengan reaksi steam reformer hingga level yang sangat kecil, dan mulai menyampurkan udara dg NG. didalam secondary reformer ini O2 dalam udara dibakar hingga menghasilkan panas yang bisa digunakan untuk reaksi steam reforming yang tersisa. Udara yang dimasukkan mengikuti ratio Nitrogen-hydrogen yang dibutuhkan untuk optimasi sintesis ammonia.
dari reaksi steam reforming diatas (baik pada primary maupun secondary) ada produk sampingan yang tidak diinginkan berupa CO, walaupun dalam tempat yang sama juga terjadi reaksi shift reaction, yang mengubah CO menjadi CO2, tetap saja masih banyak CO yang tersisa. CO dan CO2 adalah zat yang racun terhadap sintesa ammonia nantinya sehingga kedua zat ini harus dihilangkan. Prosesnya lebih lengkapnya akan dibahas dibagian selanjutnya.
Tahap 1.3:Shift Conversion:High temperature and Low temperature.
Shift Conversion dibagi menjadi 2 tahap. HTSC (high temperature shift conversion) baru kemudian LTSC (low temperature shift conversion). See gambar 6 untuk reaksi shift reaction yang terjadi. Konsep dr tahap ini adalah mengubah semua CO menjadi CO2. Pada tahapan selanjutnya akan ada tahapan CO2 removal. Sehingga baik CO maupun CO2 kandungannya sangat minim dalam Syn Gas yang akan dijadikan ammonia. Pertanyaan berikutnya adalah kenapa harus ada HTS dan LTS? Kenapa juga harus HTS dulu baru LTS dulu?
Seperti yang tertera di gambar 6 diatas shift reaction adalah reaksi eksoterm. Sehingga seharusnya reaksi tersebut dilakukan di Low Temperature. Tapi kenapa kok malah HTS yang didulukan? Itu pertanyaan bagus. Sebenernya jawabannya ada pada rate reaksinya. Pada temperature tinggi rate reaksi akan meningkat. Sehingga tujuan HTS ini adalah untuk menigkatkan rate reaksi dulu. Setelah rate reaksinya sudah cepat, maka produknya dikejar (reaksi eksoterm kan melepas panas, bila suhu sekitar lebih rendah maka panas yg dikeluarkan semakin besar, reaksi ditarik ke arah produk -> reaksi revesibel, dengan menurunkan suhu di LTSnya. Memangnya kenapa gak LTS dulu baru HTS dulu? Kan bisa juga analognya dikejar produknya dulu baru dipercepat reaksinya. Ini baru konyol (I’ve asked that too). Masalahnya ada pada reaksi shift reaction itu reaksinya reversible yang bersifat eksoterm ke arah produk, bila suhu dinaikkan akan bergeser kearah reaktan. Selain itu HTS menaikkan rate reaksi. Sehingga pergeseran ke arah reaktan tersebut akan berlangsung dg rate yg relative tinggi. Bagaikan habis jatuh ketimpa tangga pula bukan? Nah that’s why gak boleh LTS dulu baru HTS.



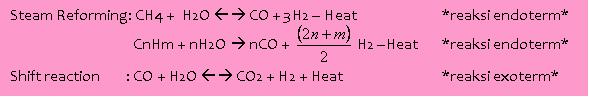









0 comment:
Post a Comment